science
Zdrowie — mutacja genów powoduje chorobę neuronów ruchowych ALS

Międzynarodowy zespół badawczy zidentyfikował rzadkie mutacje w genie leżące u podstaw wczesnej postaci choroby neuronów ruchowych stwardnienia zanikowego bocznego (ALS). Swoje odkrycia przedstawili w czasopiśmie „Nature Medicine”. Stwardnienie zanikowe boczne jest wcześniej nieuleczalną chorobą, która uszkadza nerwy i paraliżuje mięśnie, prowadząc ostatecznie do śmierci. Znany fizyk Stephen Hawking uległ ALS w 2018 roku.
Neurony ruchowe, które kontrolują mięśnie, coraz częściej umierają. Szacuje się, że na całym świecie dotkniętych jest 400 000 osób. Większość osób ze stwardnieniem zanikowym bocznym rozwija się spontanicznie między 50 a 70 rokiem życia. Dzieci mogą również rozwinąć rzadką postać choroby wywołaną mutacjami genetycznymi.
Defekt genu o nazwie SPTLC1
Zespół Carstena Bönnemanna z amerykańskiego Narodowego Instytutu Zaburzeń Neurologicznych i Udaru (NINDS) wykorzystał analizy genomu do identyfikacji mutacji genetycznych u jedenastu pacjentów z ALS, u których choroba rozwinęła się we wczesnym dzieciństwie. Wszystkie mutacje obejmowały gen o nazwie SPTLC1.
Niesie to za sobą projekt enzymu, który odgrywa ważną rolę w tworzeniu tak zwanych sfingolipidów. Są to specjalne tłuszcze, które szczególnie obficie występują w układzie nerwowym. Naukowcy odkryli, że poziomy tych tłuszczów we krwi pacjentów były nienormalnie wysokie.
Testy laboratoryjne wykazały, że „funkcja tłumiąca” enzymu jest sparaliżowana, że tak powiem, z powodu mutacji genetycznej. Współautor Thorsten Hornemann z University and University Hospital Zurich wyjaśnił agencji informacyjnej Keystone-SDA, że inne białko, które nie działa już prawidłowo w wyniku mutacji, działa jak hamulec. W związku z tym komórki będą nadmiernie wytwarzać sfingolipidy, co prowadzi do postępującego uszkodzenia nerwów i stwardnienia zanikowego bocznego.
Nowe podejście do kontroli chorób
W innych eksperymentach zespół przemycał tzw. antysensowne nici RNA przeciwko transformowanemu białku do kultur komórkowych pacjentów. W rezultacie komórki wytwarzały mniej zmutowanego enzymu, a produkcję zdegradowanych sfingolipidów można było, że tak powiem, ograniczyć.
Zdaniem naukowców ich podejście może stanowić cel molekularny w leczeniu tej rzadkiej postaci choroby. Na przykład za pomocą odpowiedniej terapii genowej lub tak zwanego inhibitora można zahamować lub spowolnić produkcję sfingolipidów. Dziewczyna z Chin z tą mutacją genetyczną jest obecnie leczona takim inhibitorem na podstawie testu, który według Hornemanna wydaje się działać. (Abba)

„Fanatyk niezależnej kawy. Namiętny ekspert od twittera. Adwokat. Introwertyk. Odkrywca. Irytująco skromny twórca. Miłośnik internetu”.
science
NASA dokonuje zaskakującego odkrycia na Marsie: „To naprawdę zagadkowe”

Naciska
Łazik Curiosity NASA dokonuje zaskakującego odkrycia w dawnym jeziorze na Marsie. Badania są zagadkowe: skąd pochodzi potrzebny nam tlen?
Los Alamos – Według NASA minerał mangan występuje na Ziemi „Niedoceniany bohater ewolucji życia”. Teraz łazik Curiosity na Marsie odkrył tlenek manganu w zaskakująco dużych ilościach na Czerwonej Planecie, co stanowi tajemnicę dla badaczy. „Tlenek manganu trudno jest wytworzyć na powierzchni Marsa, więc nie spodziewaliśmy się znaleźć go w tak wysokich stężeniach” – wyjaśnia Patrick Gasda z Narodowego Laboratorium w Los Alamos.
Zespół kierowany przez Gasdę dokonał tego odkrycia za pomocą „ciekawości”. W czasopiśmie specjalistycznym Journal of Geophysical Research: Planety opublikowany. „Na Ziemi tego typu osady występują przez cały czas, ponieważ wysoki poziom tlenu w naszej atmosferze powstaje w wyniku fotosyntezy i działania drobnoustrojów, które katalizują reakcje utleniania manganu” – stwierdza Gasda w jednym z artykułów. ogłoszenie. Nie ma jednak dowodów na istnienie życia na Marsie, a sposób wytwarzania tlenu (niezbędnego do utleniania manganu) w marsjańskiej atmosferze jest niejasny.
Łazik Curiosity NASA wykrywa tlenek manganu na Marsie – znak życia?
„To naprawdę zagadkowe, w jaki sposób powstaje i koncentruje się tutaj tlenek manganu” – podsumowuje Gasda. „Wyniki te wskazują na większe procesy zachodzące w marsjańskiej atmosferze lub w wodach powierzchniowych i pokazują, że należy zrobić więcej, aby zapobiec utlenianiu”. zostały niedawno odkryte na dnie Marsa. Jest to ważne odkrycie dla badań.
Należąca do NASA sonda Curiosity odkryła tlenek manganu w centrum krateru Gale, gdzie wylądowała w 2012 roku i od tego czasu go bada. W tym celu łazik „wystrzeliwuje” ciekawe skały, które bada za pomocą m.in. laserów. Małe jego kawałki odparowują – Curiosity następnie analizuje chmurę pary za pomocą czegoś, co nazywa się ChemCam. Zespół badawczy odkrył, że prawie połowę analizowanych skał stanowi tlenek manganu.

Curiosity znajduje tlenek manganu na brzegu podejrzanego marsjańskiego jeziora
Zespół badawczy zakłada, że miejsce, w którym Curiosity odkrył tlenek manganu, musiało znajdować się na brzegu jeziora. Mówi się, że rzeka wpadała tam do jeziora. Na Ziemi skały bogate w tlenek manganu odkryto także na brzegach płytkich jezior.
Astrobiolog Manasvi Lingam, który nie brał udziału w badaniach, wyjaśnia, że nowo odkryte skały na Marsie to „dodatkowy dowód na obecność na Marsie wody w stanie ciekłym, która jest korzystna dla życia”. Naprzeciwko bramy Nauka na żywo. „Ta praca dostarcza dowodów potwierdzających możliwość zamieszkania”.
Łazik NASA oferuje „wgląd w środowisko nadające się do zamieszkania” na Marsie
„Środowisko jeziora Gale, ujawnione przez te starożytne skały, daje nam wgląd w środowisko nadające się do zamieszkania podobne do dzisiejszych miejsc” – mówi Nina Lanza, główna badaczka instrumentu ChemCam w Curiosity. „Minerały manganu są szeroko rozpowszechnione w płytkich wodach. Woda w ziemskich jeziorach jest bogata w substancje utleniające i znalezienie tak charakterystycznych cech na starożytnym Marsie jest niezwykłe.
Łazik Curiosity NASA nie jest sam na Marsie: łazik Perseverance również bada Czerwoną Planetę, ale w innym regionie. Tam rzeczywiście rozszyfrował przeszłość wody na Marsie i odkrył kamień, który przewyższył wszystkie poprzednie odkrycia. (niezapłacony rachunek)

„Fanatyk niezależnej kawy. Namiętny ekspert od twittera. Adwokat. Introwertyk. Odkrywca. Irytująco skromny twórca. Miłośnik internetu”.
science
Mówi się, że impulsy czerwonego światła odmładzają nerwy
pte20240508001 Medycyna/wellness i badania/rozwój
Według naukowców z Uniwersytetu w Birmingham początkowy postęp nastąpił już po pięciu operacjach napromieniania
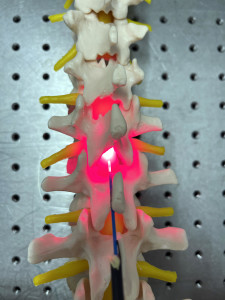 |
|
Wszczepienie światła w kręgosłup w celu stymulacji nerwów (Zdjęcie: birmingham.ac.uk) |
Birmingham (pte001/05/08/2024/06:00)
Według naukowców, pacjenci z urazami rdzenia kręgowego mogą Uniwersytet w Birmingham Nadzieja na wyzdrowienie lub przynajmniej złagodzenie jej objawów. Udało im się naprawić uszkodzone połączenia nerwowe za pomocą światła czerwonego i bliskiej podczerwieni. Światło kierowane jest bezpośrednio na miejsce urazu. Eksperci określili idealną dawkę dla nowego podejścia terapeutycznego i wykazali, że może ona prowadzić do znacznych usprawnień terapeutycznych, w tym znacznego przywrócenia czucia i ruchu, a także regeneracji uszkodzonych komórek nerwowych.
Komórki nerwowe muszą rosnąć
Światło o długości fali 660 nm ma działanie neuroprotekcyjne, czyli poprawia przeżywalność komórek nerwowych oraz neuroregenerację, czyli stymuluje wzrost komórek nerwowych. Naukowcy pod kierownictwem Zubaira Ahmeda wykorzystali modele komórkowe do określenia optymalnej częstotliwości światła i najskuteczniejszego czasu trwania promieniowania w celu maksymalizacji funkcji i stymulowania wzrostu neuronów.
Naukowcy odkryli, że ekspozycja na światło czerwone o długości fali 660 nanometrów przez jedną minutę dziennie zwiększa żywotność komórek – miarę liczby żywych komórek – o 45 procent w ciągu pięciu dni leczenia.
Kabel światłowodowy przesyła światło
Jednakże procedura ta jest obecnie odpowiednia jedynie w ograniczonym zakresie na czas niezbędny do leczenia. Źródło światła należy umieścić tam, gdzie powinno ono działać leczniczo. Można to osiągnąć poprzez wprowadzenie minimalnie inwazyjnych włókien optycznych, które po zakończeniu zabiegu są ponownie usuwane. Ahmed myśli także o opracowaniu wszczepialnych źródeł światła, które można by wprowadzić do mózgu, na przykład w celu stymulacji tamtejszych neuronów.
Operacje po urazach rdzenia kręgowego są powszechne, ale obecnie operacje te mają na celu jedynie stabilizację kości kręgosłupa, które uległy uszkodzeniu w wyniku urazu. W przyszłości chirurdzy mogliby wykorzystać tę okazję do wszczepienia urządzenia, które pomoże chronić i naprawiać rdzeń kręgowy.
(koniec)

„Fanatyk niezależnej kawy. Namiętny ekspert od twittera. Adwokat. Introwertyk. Odkrywca. Irytująco skromny twórca. Miłośnik internetu”.
science
Pył satelitarny stanowi zagrożenie dla ziemskiego pola magnetycznego? – „To bardzo niepokojące”

Naciska
Satelity spalają się w atmosferze ziemskiej, pozostawiając po sobie cząstki. Jeden z badaczy ostrzega: mogą osłabić nasze pole magnetyczne.
REYKJAVIK – Ludzkość wysyła satelity w przestrzeń kosmiczną, niezależnie od tego, czy wykorzystuje się je do monitorowania pogody, komunikacji czy badań. Od 2020 roku liczba planet krążących wokół Ziemi podwoiła się. Większość z nich należy do satelitów Starlink firmy SpaceX. Obecnie odkryto, że mogą one wpływać na pole magnetyczne Ziemi i niektóre zjawiska niebieskie.
Satelity spalają się po powrocie, pozostawiając swoje cząstki w atmosferze ziemskiej
Od lat pięćdziesiątych XX wieku w przestrzeń kosmiczną wysłano ponad 15 000 satelitów. Według serwisu Zakręć teraz Obecnie na orbicie naszej planety znajduje się 9371 satelitów, z czego 8325 znajduje się na niskiej orbicie. Każdy z nich ostatecznie powróci do atmosfery ziemskiej i spali się w miarę zmniejszania się orbity. A także satelita, który waży 1,3 tony. Niektóre satelity znajdują się na orbicie już od 30 lat. Jednak zwiększony zwrot może mieć wpływ na siłę naszego pola magnetycznego w przyszłości.
Sierra Salter z Uniwersytetu Islandzkiego, autorka nowej książki LiścieL. wyjaśnia spaceweather.com: „Oczekuje się, że w nadchodzących dziesięcioleciach zostanie wystrzelonych ponad 500 000 satelitów, głównie w celu budowy głównych terminali internetowych. Każdy satelita, który wzniesie się na górę, ostatecznie spadnie i rozpadnie się w atmosferze ziemskiej. Tworzy to ogromną warstwę przewodzącą i cząstki naładowane elektrycznie.” O naszej planecie W 2024 roku planuje się także wysłanie w przestrzeń kosmiczną drewnianego satelity.
Cząstki satelitarne mogą osłabić pole magnetyczne: „To bardzo niepokojące”
Ale Ziemia również może odczuć skutki. To zasługa pasów Van Allena. Składa się z pierścienia naładowanych i energicznych cząstek elementarnych emanujących z powierzchni Ziemi. Jego masa wynosi obecnie zaledwie 0,00018 kg. Ponowne wejście i spalanie satelitów może zwiększyć jego ciężkość. „Przemysł kosmiczny wprowadza do magnetosfery ogromną ilość materiału, którego nie można porównać z normalną ilością cząstek” – powiedział Salter. „A ponieważ śmieci satelitarne są przewodnikiem, mogą zakłócać lub zmieniać pole”.
Autor obawia się, że słabe pole magnetyczne doprowadzi do silniejszych promieni kosmicznych i burz słonecznych. „To bardzo niepokojące” – mówi Salter – „ponieważ nie możemy wrzucić do magnetosfery niezliczonych ilości przewodzącego pyłu bez spodziewania się jakichkolwiek skutków. Pilnie potrzebne są wielodyscyplinarne badania nad tym zanieczyszczeniem”.
Zanieczyszczenia pochodzące ze szczątków satelitarnych mogą wyglądać jak zorza polarna
Ale mogą również prowadzić do zmian wizualnych: śmieci satelitarne mogą powodować zorzę polarną. Ale to zależy od tego, ile materiału stracą satelity. wyjaśnia Sandra Chapman, astrofizyk z Uniwersytetu w Warwick Newsweek: „Gdyby więc tę masę rzeczywiście wpompowano do pasa promieniowania, zaobserwowalibyśmy efekty w rodzaju silnej zorzy polarnej”.(NIE)

„Fanatyk niezależnej kawy. Namiętny ekspert od twittera. Adwokat. Introwertyk. Odkrywca. Irytująco skromny twórca. Miłośnik internetu”.
-
Tech3 lata ago
Te oferty Apple nadal istnieją
-
Top News2 lata ago
Najlepsze strategie i wskazówki dotyczące zakładów na NBA
-
Tech3 lata ago
Kup PS5: Expert bez nowych konsol – kiedy nadejdą dostawy?
-
Tech3 lata ago
Windows 11 dla programistów: aplikacje na Androida, zestaw gier i pakiet Windows SDK
-
Economy3 lata ago
Huobi Global rozpoczął kampanię zerowej opłaty dla użytkowników kart bankowych w Europejskim Obszarze Gospodarczym i Wielkiej Brytanii
-
entertainment3 lata ago
Dieter Bohlen ogłosił nową pracę w telewizji – to zaskakujące
-
entertainment3 lata ago
„Helene Fischer Show”: Nagłe zakończenie bożonarodzeniowego show – ostre słowa ZDF
-
Tech4 miesiące ago
Ubóstwo CO2 może ujawnić łatwość życia – Wissenschaft.de






